神经紧张素(NTS)是由淋巴管内皮细胞产生的分泌肽,以往研究表明NTS通过旁分泌信号与与神经降压素受体2(NTSR2)相互作用,抑制棕色脂肪组织的活性。然而,NTSR2的细胞类型特异性作用和长期生理功能,特别是它在白色脂肪细胞中的作用方式仍然未知。
2025年1月3日, 复旦大学生命科学学院李晋研究员、黄河研究员、郑琰研究员团队在Cell Research (IF28.1)发表题为“Neurotensin-Neurotensin Receptor 2 signaling in adipocytes suppresses food intake through regulating ceramide metabolism”的研究论文。文章阐明白色脂肪细胞中的NTS-NTSR2信号可以通过直接控制脂质代谢和GDF15的产生来调节食物摄入,神经酰胺C20-C24是调节哺乳动物食物摄入的关键因素。
· 维真助力·AAV
基因信息
Gfral:神经营养因子家族ɑ样受体
实验动物
10-12周龄雄性小鼠
病毒产品
AAV-shGfral
注射方式及用量
脑立体定位注射,30nL
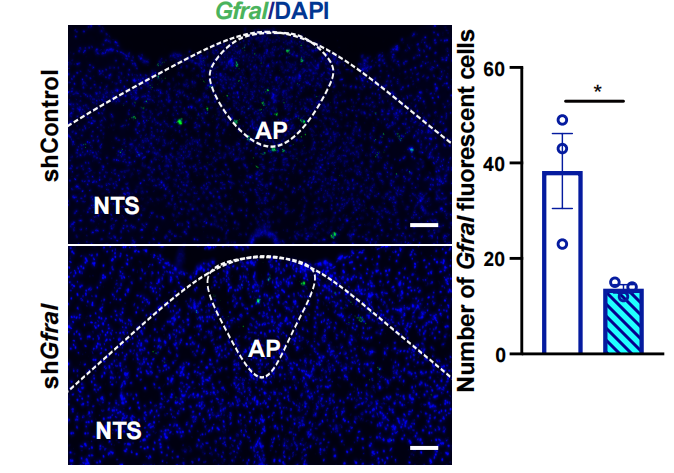
AAV-shGfral有效降低AP/NTS区Gfral的表达
01 研究结果
1、白脂肪细胞中的NTS-NTSR2信号调节食物摄入
转录组学分析发现,HFD显著上调了Ntsr2的表达,特别是在附睾WATs(eWAT)中,因此研究团队进一步探讨了NTSR2在白色脂肪细胞中的功能。通过建立Ntsr2脂肪细胞特异性敲除小鼠模型,发现正常饮食饲养的Ntsr2 AKO小鼠和对照组小鼠体重担当,但当喂食HFD时,Ntsr2 AKO小鼠的体重高于对照组小鼠;当把Ntsr2 AKO小鼠饲养于热中性环境中时,体重也出现了类似的升高。此外,Ntsr2 AKO小鼠在葡萄糖耐量试验和胰岛素耐量试验中的表现也较差。与Ntsr2-BKO小鼠相比,Ntsr2 AKO小鼠的食物摄入量显著增加;通过对Ntsr2-AKO小鼠进行配对喂养,发现Ntsr2 AKO小鼠的代谢变化主要是由食物摄入引起的。将含有重组NTS肽的水凝胶注射到野生型C57BL6/J小鼠的iWAT或eWAT中,结果显示NTS的局部释放导致瘦小鼠和肥胖小鼠的食物摄入量减少,但对Ntsr2-AKO小鼠的食物摄入没有影响,表明NTS通过与脂肪细胞中的NTSR2相互作用来调节食物摄入。上述结果表明,NTS-NTSR2信号通过对脂肪组织的直接影响来调节食物摄入。
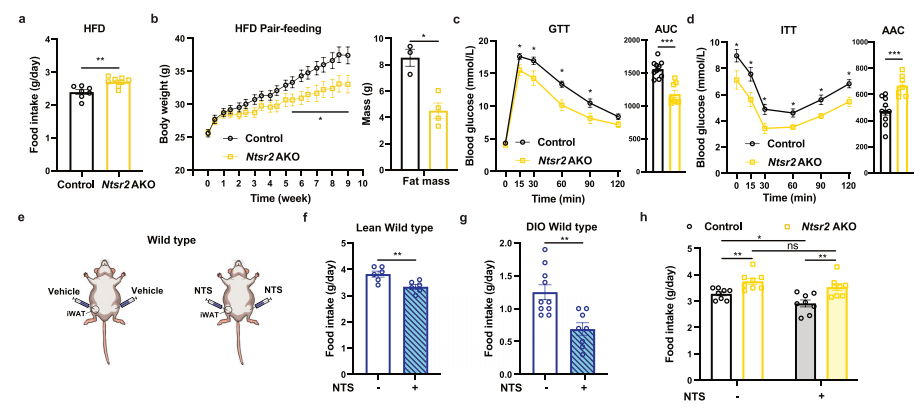
脂肪组织中的NTS-NTSR2信号调节食物摄入
2、NTS-NTSR2信号传导影响脂肪细胞神经酰胺代谢
磷酸化蛋白质组学分析显示Ntsr2耗竭诱导了CerS2蛋白磷酸化的升高,免疫印迹结果证实NTS抑制了原代脂肪细胞中CerS2的磷酸化。通过脂质组学测定发现在Ntsr2 AKO小鼠的eWAT中,作为CerS2产物的C20-C24神经酰胺在所有神经酰胺中增加。由于内源性神经酰胺合成对食物摄入的生理功能尚未被报道,研究人员建立了CerS2基因单拷贝缺失小鼠模型。CerS2+/-小鼠的食物摄入量减少,并在局部补充WATs中神经酰胺C22(而非C16)后得到上调。将含有shRNA的AAV注射到iWAT或eWAT中来敲低CerS2,可以降低局部神经酰胺C20-C24的丰度;CerS2敲低也使Ntsr2-AKO诱导的食物摄入上调正常化。这些数据表明,脂肪细胞中的神经酰胺代谢有助于NTS-NTSR2信号调节食物摄入。进一步的分析表明NTS-NTSR2信号调节神经酰胺C20-C24的合成,进而影响WATs中UPR的水平。
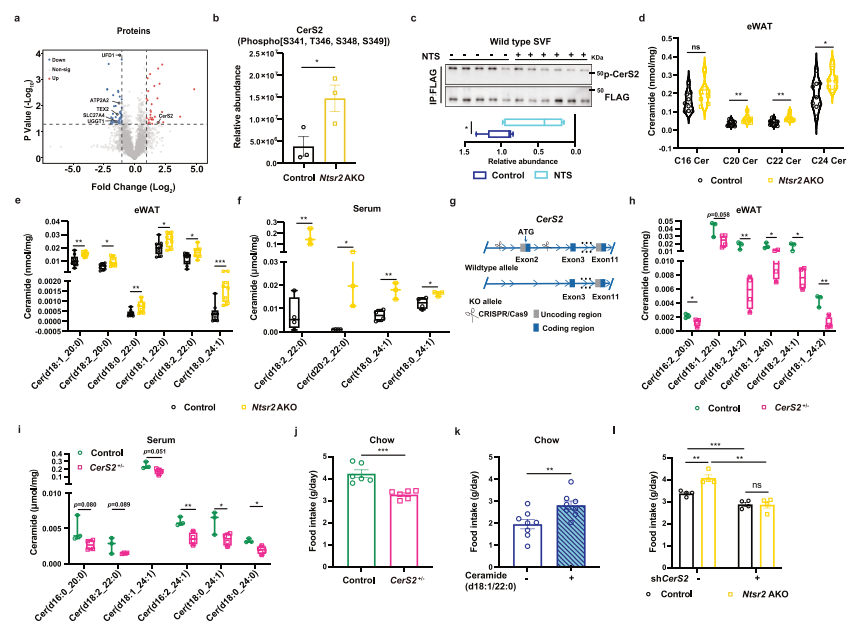
NTS-NTSR2信号调节WATs神经酰胺代谢
3、NTS-NTSR2信号通过调节GDF15影响食物摄入
研究人员发现Gdf15基因及其编码产物GDF15在Ntsr2-AKO小鼠的eWAT和iWAT(但不是BAT)中下调;不仅如此,GDF15蛋白在喂食饲料或HFD的Ntsr2-AKO小鼠的血清中也下调。相比之下,iWAT中水凝胶局部释放NTS肽上调了瘦和肥胖小鼠的血清GDF15。为了验证对照组和Ntsr2-AKO小鼠之间的食物摄入差异是否依赖于GDF15信号传导,研究人员通过AAV注射敲低GDF15受体Gfral。结果显示,Gfral的敲低消除了iWAT中Ntsr2-AKO或NTS局部治疗引起的食物摄入变化,并使NTSR2 AKO小鼠的体重增长速度减慢。表明WATs中的NTS-NTSR2信号通过GDF15信号调节食物摄入。进一步测试表明,NTS-NTSR2信号传导调节了C20-C24神经酰胺的合成,从而影响了小鼠GDF15的产生和食物摄入。
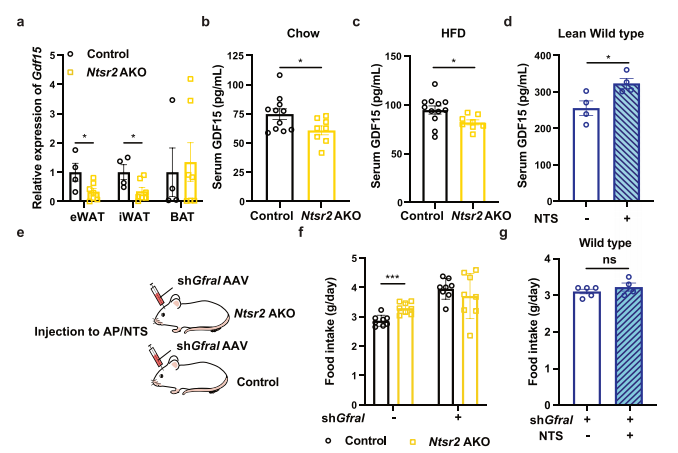
GDF15水平的降低导致 Ntsr2 AKO小鼠食物摄入量的增加
02 研究结论
本研究为NTS-NTSR2信号在代谢调节中的功能和相关机制提供了独特的见解。除了NTS,还发现了LEC产生的其他分泌蛋白,这些研究将共同启发未来关于LEC如何通过分泌蛋白与外周器官/组织相互作用以及如何调节代谢稳态的工作。
