美国埃默里大学叶克强教授等人于2022年1月在Gut(IF 23.059)期刊发表题为“Gut microbiota regulate Alzheimer’s disease pathologies and cognitive disorders via PUFA associated neuroinflammation”的文章,该研究通过阿尔茨海默病(Alzheimer’s disease,AD)小鼠模型和人源化粪菌移植(FMT)实验发现,AD相关肠道菌群(以拟杆菌属富集为特征)可通过激活C/EBPβ/AEP通路,并上调促炎症性的多不饱和脂肪酸(Poly-unsaturated fatty acid,PUFA)代谢,以增强小神经胶质细胞活化及神经炎症,从而促进AD病理及认知障碍。这些发现支持行为缺陷、小胶质细胞激活和AD病理需要复杂的肠道微生物组,肠道微生物组有助于AD小鼠模型的病理,并且人类微生物组的失调可能是AD的危险因素。

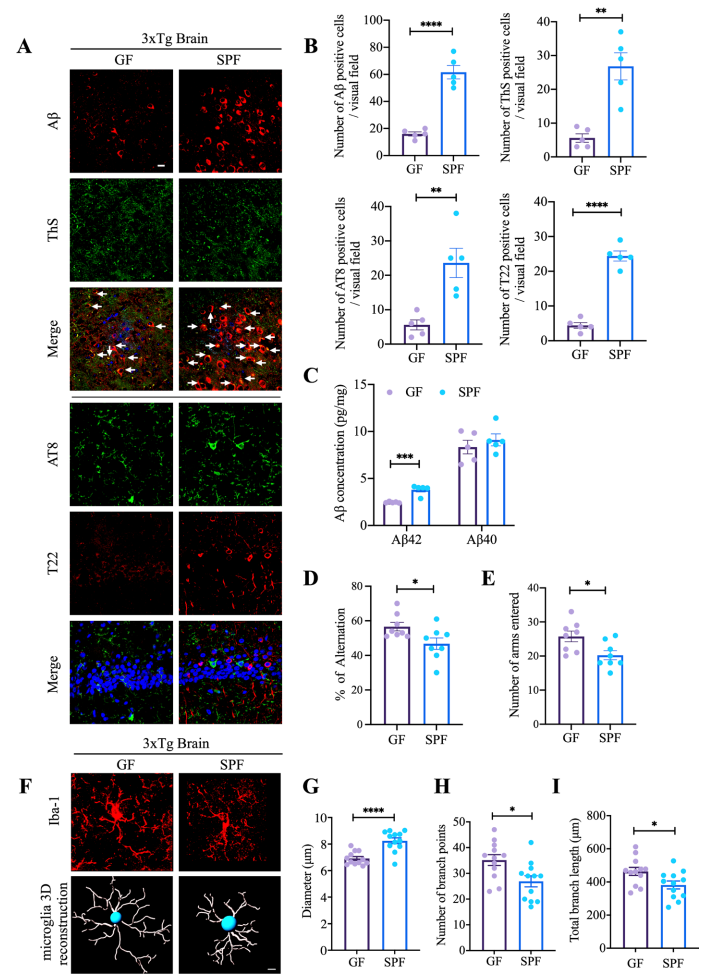
图1 与SPF小鼠相比,无菌小鼠显示出AD病理减少和认知功能改善
2. 肠道菌群激活C/EBPβ/AEP通路,提高PUFA代谢相关促炎酶表达水平
最近的研究表明C/EBPβ/AEP信号通路在时间和空间上调控AD病理,为了评估是否需要完整的肠道微生物组来刺激这一通路,从而导致AD发病机制,作者通过免疫印迹分析,发现与SFP小鼠相比,GF小鼠大脑中的C/EBPβ/AEP信号传导减弱,作为记忆障碍导致AD发病和炎症核心网络的花生四烯酸(AA)代谢途径相关的Lox5、Cox1和Cox2水平明显降低(图2 A、B)。蛋白酶测定显示GF小鼠的AEP酶活性低于SPF小鼠,这与活性AEP水平降低保持一致(图2 C)。GF小鼠中IL-6浓度(C/EBPβ是其主要转录因子)显著降低(图2 D)。qPCR结果显示,GF小鼠的CEBPβ靶点/AA通路基因表达下降(图2 E),与RNAseq数据趋势一致。上述结果表明,复杂的肠道菌群促进AD小鼠模型的病理过程。
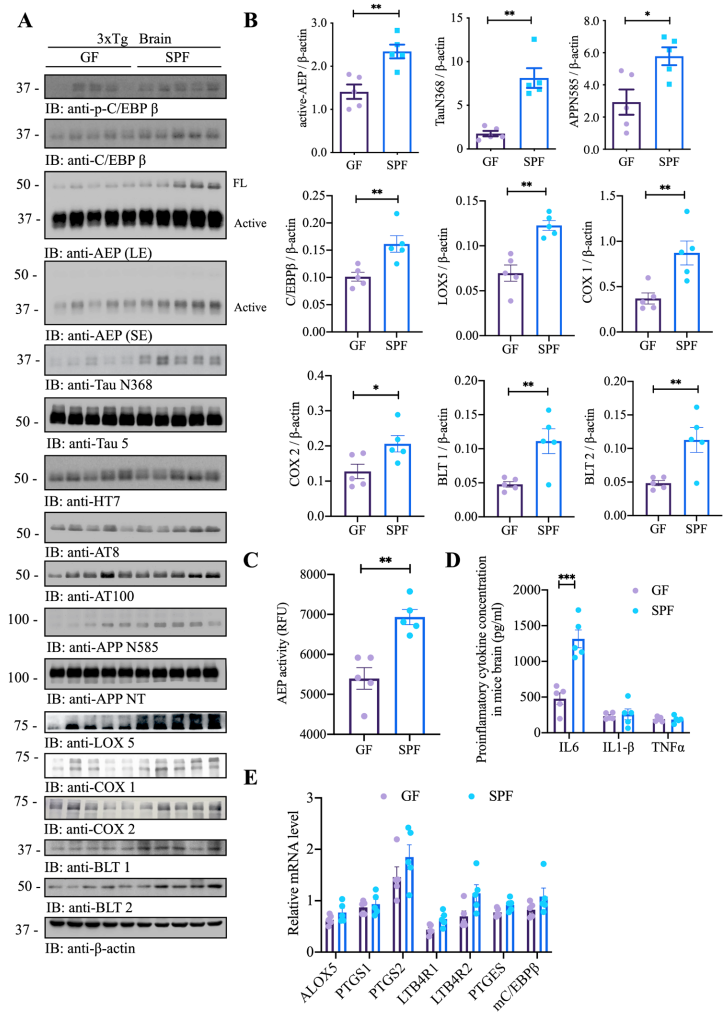
图2 无菌小鼠表现出减弱的C/EBPβ/AEP通路和AA相关炎症
3. 肠道菌群提高炎症代谢物水平,并改变大脑中的炎症和胰岛素/IGF-1途径
为了评估肠道微生物组对AD相关转录反应的整体影响,作者对GF和SPF小鼠海马样本转录组测序,结果显示两者整体基因表达模式存在显著差异,与GF小鼠相比,参与AA代谢途径的基因在SPF小鼠中差异表达(上调:Hpgd、Ptges3和Cyp1b1;下调:Ptges2),这与上述的观测结果相符(图3 A-D)。此外,SPF小鼠的胰岛素信号传导及其相关的下游途径发生了异常改变,免疫印迹实验也证明了这一结果(图3 E、F)。这些结果表明,肠道菌群影响AD小鼠海马区基因的表达。
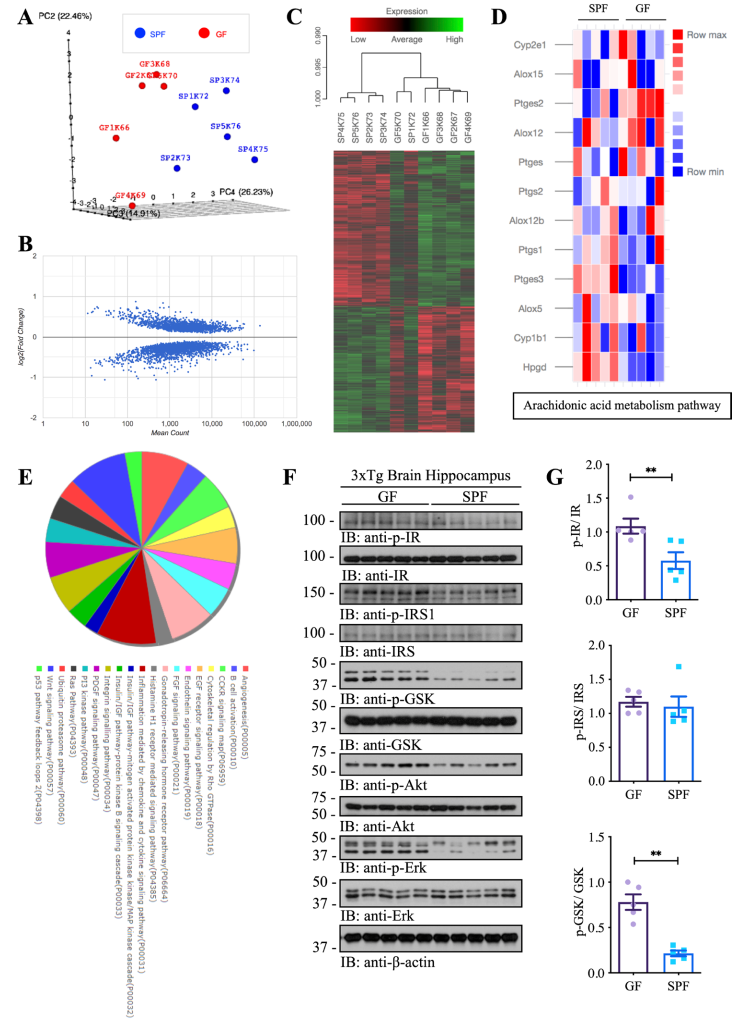
图3 肠道菌群影响AD小鼠模型海马区mRNA表达的转录组图谱
4. SCFAs可引起GF小鼠C/EBPβ/AEP激活、认知障碍和炎症反应,并被PGE2-G促进
前期研究表明SCFAs与AD相关,GF小鼠粪便和血清中SCFAs水平降低。为了研究SCFAs是否会部分模拟定殖SPF小鼠的肠道菌群触发C/EBPβ/AEP通路激活,作者设置了GF小鼠SCFAs补充饲喂实验。结果表明,相比对照GF小鼠,补充SCFAs小鼠中C/EBPβ下游靶标、AEP蛋白酶活性、IL-6和Aβ42水平显著增加,认知缓解水平降低(图4 A-H)。代谢组分析结果显示,与SPF相比,GF小鼠粪便中的PUFA代谢物显著减少,同时补充SCFAs和PGE2-G(代谢组分析鉴定出的标志物)刺激小胶质细胞形态的成熟和活化(图4 J-L)。这些结果表明SCFAs可引起GF小鼠C/EBPβ/AEP激活、认知障碍和炎症反应,并被PGE2-G促进。
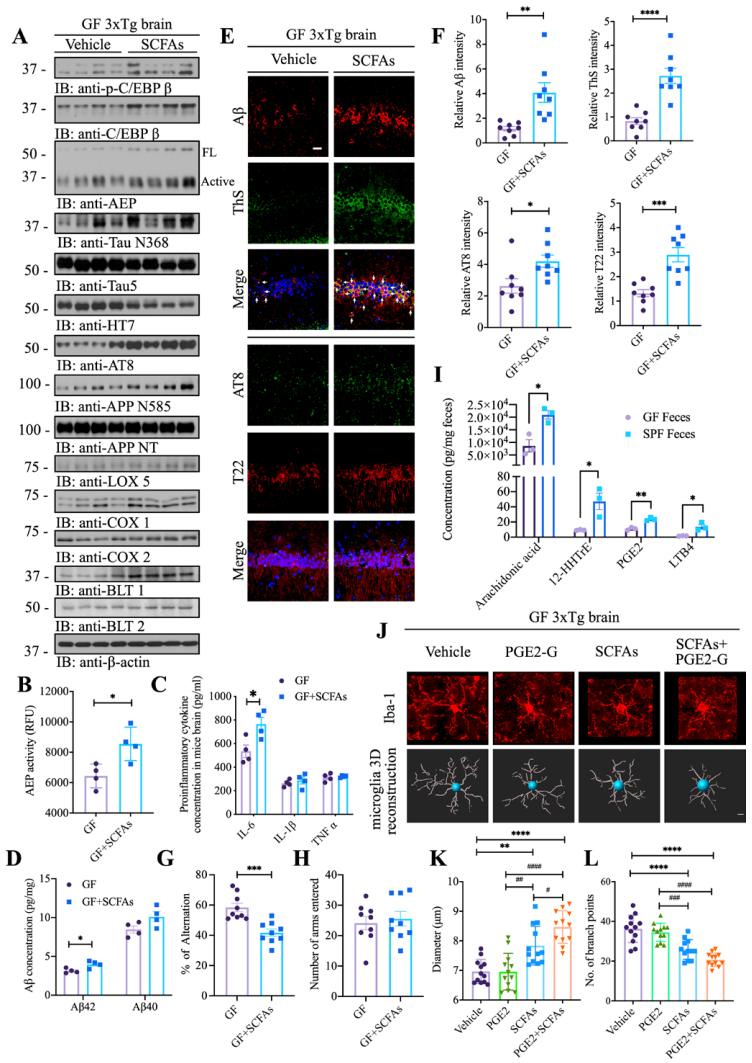
图4 SCFAs引发无菌小鼠炎症反应中C/EBPβ/AEP的激活和认知缺陷,PGE2-G能加剧这些反应
5. FMT后受体小鼠肠道特定菌群增加,增强AD病理,促进认知障碍
为了确定人源性肠道菌群在转移到GF小鼠时是否会影响疾病结果,作者分别将AD患者和健康人(HC)粪便移植给GF小鼠。结果显示受体小鼠肠道菌群和供体相似,AD受体小鼠中拟杆菌属的3个种相对丰度显著增加(图5 A-E),体外定量实验表明,这3种微生物参与AA代谢,并产生AA衍生物(图5 I)。免疫荧光(IF)实验结果显示,受体小鼠ThS阳性Aβ聚集体、AT8/T22和Aβ42增加(图6 A-C)。与HC小鼠相比,AD受体小鼠在Y迷宫中表现出认知缺陷,小胶质细胞高度活化且形态成熟(图6 D-K)。这些结果表明AD患者肠道菌群会促进GF受体小鼠AD进程。
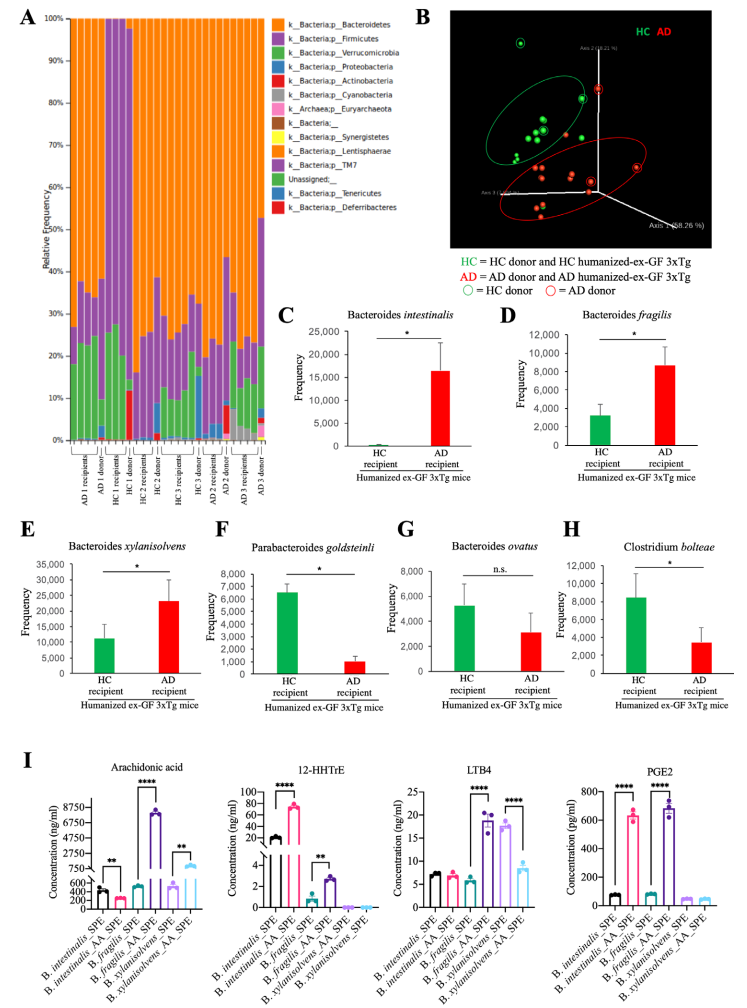
图5 移植AD患者粪菌后的无菌小鼠肠道拟杆菌属相对丰度升高
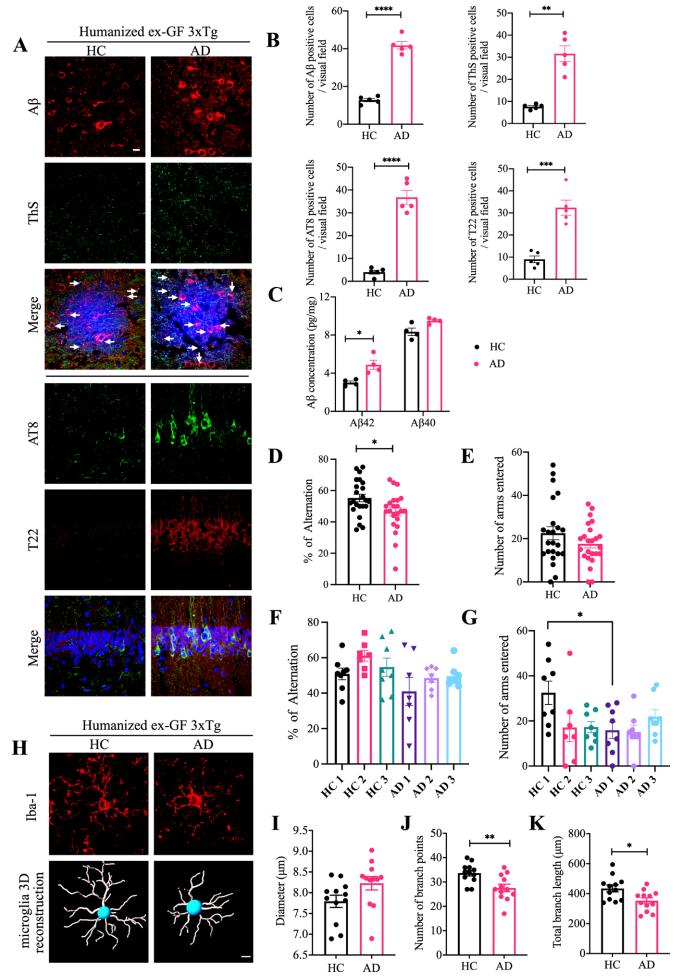
图6 移植AD患者粪菌后的无菌小鼠表现出增强的AD病理和认知缺陷
6. FMT后受体小鼠C/EBPβ/AEP通路激活且与炎症水平升高相关
免疫印迹结果显示p-C/EBPβ及其总蛋白、AEP及其上游转录因子、C/EBPβ及其下游响应基因水平均显著增加(图7 A-C)。炎性细胞因子定量和qPCR实验结果显示,AD受体小鼠中IL-6和IL-1β、ALOX-5相关基因表达水平显著增加(图7 D、E)。
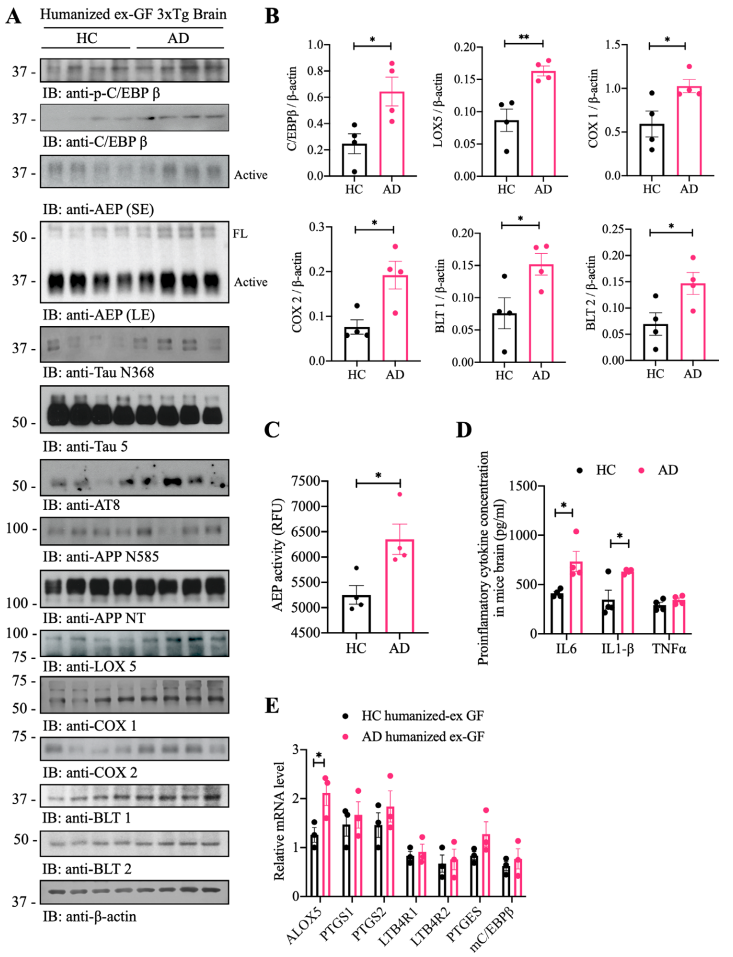
图7 移植AD患者粪菌后的无菌小鼠小鼠表现出C/EBPβ/AEP通路激活且与炎症水平升高相关
小编小结
本文的研究结果表明,人类微生物组可能是阿尔茨海默病的危险因素。通过个性化饮食、有益微生物群干预以及粪菌移植来调节肠道微生物群或可有助于减少炎症和治疗包括AD在内的脑部疾病。
中科优品推荐
【中科新生命】全面推出肠道微生物群-免疫系统多组学解决方案,多角度、多层次、全方位深入挖掘肠道菌群和免疫系统之间的关联性,并结合表型结果,拟帮助科研人员开发一种新型干预性措施的潜在靶点。
肠-免疫-靶轴系统研究方案
· 16s/宏基因组----肠道微生物的组成及改变
· 免疫代谢组----肠道微生物产生的用于调控机体免疫的代谢物
· 免疫因子组----肠道微生物如何影响机体免疫
· 转录/蛋白质组----对终端靶器官应对炎症响应机制的系统描述